抗うつ作用に重要な脳領域を発見
マウントサイナイ医科大学神経科学PhDプログラム
大学院生
九野(川竹)絢子
大学院生
九野(川竹)絢子
ケタミン並びにその誘導体は、うつ病の新規治療薬候補として着目されていますが、どのような脳内メカニズムが抗うつ作用に関わっているのかはまだ不明です。本研究では、ケタミン誘導体の持続的な抗うつ作用に、視床室傍核における特定の分子機序が必須であることを明らかにしました。
うつ病に対する治療薬として抗うつ薬が使用されますが、従来の抗うつ薬は治療効果がでるまでに数週間かかることや、一定期間治療をしても効果がみられにくい(治療抵抗性)患者さんがいることなどが問題となっており、即効性・持続性を有する新たな抗うつ薬の開発が望まれています。そのような中、麻酔薬として使用されているケタミンは、治療抵抗性うつ病患者さんに対して即効性・持続性の抗うつ作用をもたらすことが分かってきました。ケタミンは2つの光学異性体を有し、最終的に(2S,6S)-/(2R,6R)- hydronorketamine (S-HNK /R-HNK)に代謝されます。ケタミンには依存性・多動などの重篤な副作用がありますが、ケタミン誘導体にはそのような副作用が少ないことが知られており、より安全性の高い新規抗うつ薬候補として期待されます。しかし、ケタミン誘導体による抗うつ作用のメカニズムはよく分かっていませんでした。そこで本研究では、ストレスを負荷したうつ病モデルマウスを用いて、S-HNKによる持続的な抗うつ効果とその脳内メカニズムの解明を試みました。
まず、マウスに心理的なストレスを繰り返し与え、うつ状態と考えられる行動異常(他のマウスとの交流を避ける(社交性低下)・砂糖水を飲まなくなる(無快感症))を示したマウスにS-HNKを単回投与しました。薬剤投与後に再度行動評価を行ったところ、S-HNK投与群で30分後 に抗うつ作用 (社交性低下並びに無快感症の改善)を認め、その効果は28日間持続していました。
次に、S-HNK, R-HNK投与後のマウスの脳神経活動をc-Fosという神経活動の指標を用いて調べたところ、視床室傍核という領域がS-HNK投与に対して特異的に神経活動の変化を示すことが分かりました。さらに、持続的な抗うつ作用に関わる視床室傍核内の分子メカニズムの同定を試みました。RNA-seqを含めた網羅的遺伝子発現解析の結果から、心理社会的ストレス負荷後のうつ様行動ならびにS-HNKによる抗うつ様行動には1)うつ病や抗うつ薬との関連が報告されているGnb3遺伝子の変化、2 )抑制性受容体のひとつであるGABAA受容体群の機能変化、が重要であることが示唆されました。アデノ随伴ウイルスを用いてこれら分子の機能を獲得/欠失させることで、うつ様行動並びにS-HNKによる抗うつ作用との因果関係を検証した結果、S-HNKによる持続性抗うつ作用には、GABAA受容体による抑制性シグナリングを介してGnb3遺伝子の発現が調節されることが重要であると分かりました(図1)。
半世紀以上前に偶発的に抗うつ薬が発見されて以降、多くの研究がよりよい抗うつ薬の開発に取り組んできましたが、うつ病の薬物療法は未だ発展途上です。本研究で明らかになった分子神経メカニズムを基盤に、より副作用が少なく即効性・持続性を有した抗うつ薬の開発が期待されます。
<掲載ジャーナル>
Sustained antidepressant effects of ketamine metabolite involve GABAergic inhibition-mediated molecular dynamics in aPVT glutamatergic neurons.
Kawatake-Kuno A, Li H, Inaba H, Hikosaka M, Ishimori E, Ueki T, Garkun Y, Morishita H, Narumiya S, Oishi N, Ohtsuki G, Murai T, Uchida S.
Neuron. 2024 Feb 9:S0896-6273(24)00049-7.
doi: 10.1016/j.neuron.2024.01.023.
Kawatake-Kuno A, Li H, Inaba H, Hikosaka M, Ishimori E, Ueki T, Garkun Y, Morishita H, Narumiya S, Oishi N, Ohtsuki G, Murai T, Uchida S.
Neuron. 2024 Feb 9:S0896-6273(24)00049-7.
doi: 10.1016/j.neuron.2024.01.023.
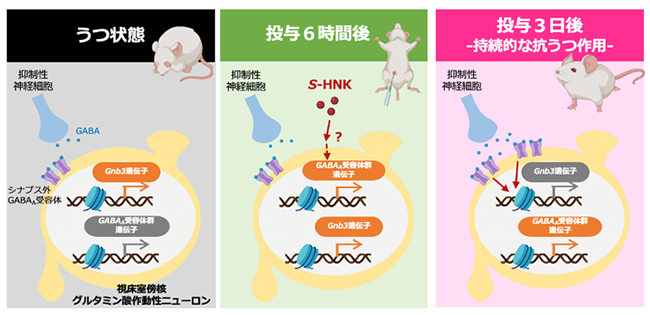
<図の説明>
- うつ状態:ストレス負荷により視床室傍核グルタミン作動性ニューロン内でGnb3遺伝子の転写が亢進しうつ状態を誘発する。
- 投与6時間後:S-HNK投与後、視床室傍核グルタミン作動性ニューロンの活動が一過的に活性化することにより、GABAA受容体群の遺伝子発現が亢進する
- 投与3日後(持続的な抗うつ作用):GABAA受容体の発現が増加し、視床室傍核グルタミン作動性ニューロンの活動が持続的に抑制される。さらにGABAA受容体の抑制性シグナルによってGnb3の発現が低下し、持続的な抗うつ作用を誘導する。
<研究者の声>
精神疾患のエピジェネティクス制御に興味を持っていたことなど、様々なきっかけが重なって本プロジェクトを始めるに至りました。臨床と研究を同時並行する中で、臨床現場では患者さんの背景や中長期的な症状変化を通して捉えていたうつ病や抗うつ薬の効果が、研究技術を用いると脳神経回路・分子レベルで還元的に説明できるという状況に、頭の切り替えが難しいこともありました。一方で、両者が確立していく精神疾患の概念には隔たりがありつつも接合点も見い出せることを知りました。どのようにすれば基礎研究を精神科臨床へ還元していけるのか、常に考えながらこれからも研究をしていきたいです。 あらゆる実験技術を一から教えて下さり、寛大な心で多大なるご指導をいただいた内田周作先生並びに皆様に心より感謝申し上げます。
<略歴>
| 2020年3月 | 京都大学医学部医学科卒業 |
| 2020年4月〜2022年3月 | 京都大学医学部附属病院研修医 |
| 2022年4月〜2022年7月 | 京都大学大学院医学研究科SKプロジェクト 非常勤研究員 |
| 2022年8月〜2023年7月 | マウントサイナイ医科大学修士プログラム |
| 2023年8月〜 | マウントサイナイ医科大学神経科学PhDプログラム |






