脳梗塞による細胞死を抑える分子メカニズム
香川大学 医学部 分子神経生物学
助教
高橋弘雄
助教
高橋弘雄
脳梗塞が起こると、虚血部位では多くの神経細胞が死に至ります。本研究は、脳梗塞が起きる前の神経活動により、神経細胞が虚血に対して抵抗性を獲得する現象を見出しました。そして、この“脳梗塞による細胞死を抑える分子メカニズム”を明らかにしました。
脳梗塞を含む脳血管疾患は、本邦死因の上位を占め、また要介護者を生む大きな原因となっています。虚血による神経細胞死をいかに防ぐか?という点は、脳梗塞の治療における重要なポイントです。これまでに、主に動物モデルを用いた研究から、脳梗塞が起こる以前の動物個体の状況が、その後の脳梗塞の症状に影響を及ぼすことが知られていました。例えば、数週間の運動をしたマウスや、遊具が置かれ刺激の多いケージで一ヶ月過ごしたラットは、その後、脳梗塞に陥った場合でも神経細胞死が顕著に軽減します。私たちの研究グループは、もっと短期間の刺激でも、脳梗塞の症状に影響を及ぼし得るのではないかと考え、研究を行いました。様々な遊具が置かれた刺激の多い環境で40分過ごしたマウスでは、その後の脳梗塞による神経細胞死が顕著に減弱しました(図A, B)。健常な動物が充実した環境で過ごすことで脳の神経活動が亢進し、その結果神経細胞を保護する分子メカニズムが活性化して脳は一過性の虚血耐性を獲得すると考えられました。類似の現象として、予め軽度の虚血処理を行ったマウスも、一過性の虚血耐性を獲得することが知られていました。そこで私たちは、マウスが刺激の多い環境で過ごした場合と、虚血が起こった場合の双方で、共通に活性化する神経保護メカニズムがあるのではないかと考え、どちらの状況でも発現が変化する遺伝子を探索しました。2つのスクリーニングを組み合わせて行い、有望な候補遺伝子として、転写因子Npas4(Neuronal PAS domain-containing protein 4)を見出しました。
これまで私たちを含む複数のグループの研究から、健常な脳のさまざまな領域で、神経活動に伴うCa2+シグナルによりNpas4が発現することが知られていました。一方、脳梗塞を発症すると、神経細胞ではエネルギーの欠乏により膜電位が上昇し、異常なCa2+流入が起こります。本研究において、マウスが刺激の多い環境で過ごした場合と、脳梗塞を発症した場合の双方の状況で、Npas4は大脳皮質の神経細胞において発現が誘導されました。そこで次に、脳梗塞におけるNpas4の役割を検討しました。これまでNpas4は、虚血による細胞死を防ぐ作用を持つことが報告されていました。本研究においても、Npas4を欠損したマウスでは、脳梗塞による細胞死が過剰に起こり、逆にNpas4を強く発現させたマウスでは、脳梗塞による細胞死が抑制されました。さらに、Npas4欠損マウスでは、予め刺激の多い環境で過ごした場合でも虚血耐性を獲得できないことが分かりました。これらの知見をまとめると、脳梗塞が起こると神経細胞ではNpas4の発現が誘導され、Npas4は細胞死を抑えるために働きます。刺激の多い環境で予めNpas4の産生を促進しておくと、その後脳梗塞に陥ってもNpas4が速やかに働くために、細胞死が軽減されると考えられます。さらに、Npas4が神経細胞死を防ぐ仕組みを検討した結果、Npas4が低分子量Gタンパク質Gemの発現を誘導すること、GemがL型電位依存性Ca2+チャネルの細胞膜への局在を阻害することを見出しました。Npas4欠損マウスでGemを強く発現させると、脳梗塞に伴う過剰な細胞死がレスキューされることから、Npas4はGemの発現を促進することにより、虚血時の神経細胞で起こる異常なCa2+流入を抑え、細胞死を抑制すると考えられます。
興味深いことに、ヒトiPS細胞から作製した大脳皮質オルガノイドにおいても、虚血様処理によりNpas4やGemの発現が誘導されます。Npas4やGemはマウスのみならず、ヒトでも脳梗塞の際に働いていると推測されます。今後、”脳梗塞から脳を守るメカニズム”に関する研究を更に進めて、人為的にこれを強く活性化することが可能となれば、脳梗塞による細胞死を抑える新たな治療法に繋がると期待されます。また、Npas4およびGemの発現誘導は、健常な脳でも、脳梗塞時の脳でも見られます(図C)。過剰な神経活動やそれに伴う持続的なCa2+流入は、神経細胞に興奮性の細胞死を引き起こします。Npas4欠損マウスでは、加齢に伴って、脳で神経細胞の細胞死が多く見られることが報告されています。今回私たちが見出した、Npas4によるGemを介した電位依存性Ca2+チャネルの抑制は、健常な脳においても、神経細胞におけるCa2+シグナルのレベルを適切に保ち、細胞死を未然に防ぐために日々働いている可能性が考えられます。また、健常な脳でNpas4は、神経活動依存的にシナプス形成を促進し、記憶や学習に必須の役割を果たします。今回の研究で明らかとなった、Gemによる電位依存性Ca2+チャネルの活性調節が、健常な脳において果たす役割に関しても、今後検討して行きたいと考えています。
論文タイトル:
Ras-like Gem GTPase induced by Npas4 promotes activity-dependent neuronal tolerance for ischemic stroke
著者:
Takahashi H*, Asahina R, Fujioka M, Matsui TK, Kato S, Mori E, Hioki H, Yamamoto T, Kobayashi K, Tsuboi A* (*責任著者)
掲載誌:
Proc Natl Acad Sci U S A. 2021, August 10; 118(32); e2018850118;
https://doi.org/10.1073/pnas.2018850118
https://doi.org/10.1073/pnas.2018850118
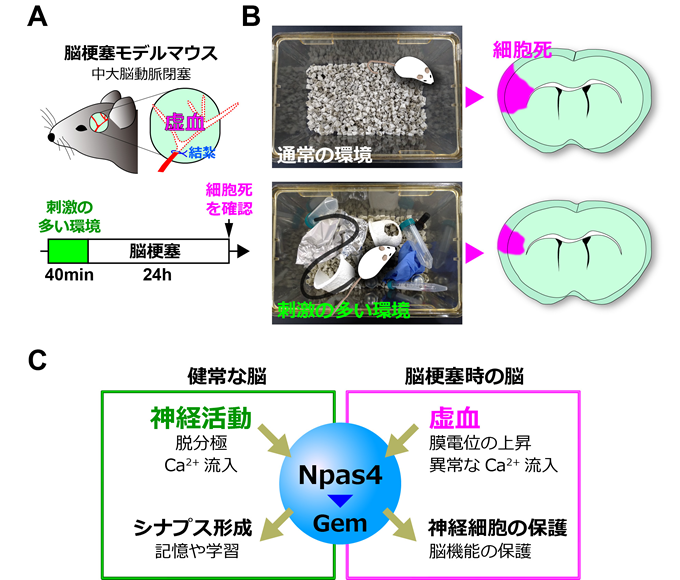
<図の説明>
- 実験の流れ:様々な遊具が置かれた刺激の多い環境で40分過ごしたマウスを用いて、脳梗塞モデル(中大脳動脈閉塞)を作製した。24時間後に生細胞を染色し、脳梗塞による細胞死を定量した。
- 刺激の多い環境で過ごしたマウス(下段)は、通常の環境で過ごしたマウス(上段)と比較して、脳梗塞による細胞死が顕著に減少した。外界からの刺激により、マウスは脳梗塞への抵抗性を一時的に獲得したと考えられる。
- 健常な脳と脳梗塞時の脳におけるNpas4の働き:健常な脳では、神経活動に伴うCa2+シグナルにより、Npas4の発現が誘導される。Npas4は、シナプス形成を促進する。一方、脳梗塞が起こると、虚血によりエネルギーが欠乏した神経細胞では、異常なCa2+流入が起こり、Npas4の発現が誘導される。Npas4はGemの発現を促進することで、神経保護作用を示す。健常な脳で、神経活動により予めNpas4を誘導すると、Gemの発現が促進され、神経細胞は虚血への抵抗性を一時的に獲得する。Npas4は細胞内のCa2+濃度の上昇に反応して、必要なメカニズムを活性化する、センサーのような役割を果たす。
<研究者の声>
この研究は、私が奈良医大・坪井研の助教であった時に、当時、医学科2年生だった朝比奈諒先生(現、早稲田大学)と共にスタートしました。当初は、脳梗塞モデルの作製にすら悪戦苦闘して、なかなか安定した結果も得られませんでした。その後、私が香川大学に移った後も研究は継続し、一年半近いリバイスを経て、ようやく論文として発表することができました。ヒト大脳皮質オルガノイドに関するデータは、奈良医大の森英一朗先生と、松井健先生(現、島根大学)による苦心の成果です。研究を熱心にご指導頂いた坪井昭夫先生(現、大阪大学)をはじめとして、山本融先生や、共同研究者の先生方、支えて頂いた多くの方々に、この場を借りて心から感謝します。
<略歴>
2003年 総合研究大学院大学 基礎生物学専攻修了 博士(理学)
2003年 基礎生物学研究所 統合神経生物学研究部門(野田昌晴教授) 研究員
2006年 奈良県立医科大学 脳神経システム(坪井昭夫教授) 助教
2017年 同上 講師
2018年 香川大学 分子神経生物学(山本融教授) 助教
2003年 基礎生物学研究所 統合神経生物学研究部門(野田昌晴教授) 研究員
2006年 奈良県立医科大学 脳神経システム(坪井昭夫教授) 助教
2017年 同上 講師
2018年 香川大学 分子神経生物学(山本融教授) 助教






