2021年度時実利彦記念賞受賞者 野田 昌晴 先生
水分および塩分欲求を制御する脳内機構の研究
伝統ある賞にお選びいただき関係者の皆様に感謝申し上げます。
私は大学では、公害問題解決の一助になればと京大工学部の化学系を選んだ訳ですが、修士課程を終える頃には基礎研究の方がおもしろくなり、大学院の後期課程では医学研究科(京大医化学II:沼正作教授)に進学しました。大学院生から助手時代にかけて、エンケファリン前駆体の構造をcDNAクローニングによって明らかにするとともに、ニコチン性アセチルコリン受容体の全サブユニット(α、β、γ、δおよびε)のクローニングを行いました。続いて直ぐに助教授となったため、同教室でさらに数年過ごしてNaチャンネルの構造と機能の研究を行いました。その後、MPI発生生物学研究所(F. Bonhoeffer教授)へ留学しましたが、研究半ばで基礎生物学研究所の教授に選ばれ、急いで帰国することにしました。研究室を立ち上げるに当って3つのテーマを設定しました。①発生期における網膜の領域特異化と視神経の領域特異的投射の機構 ②受容体型プロテインチロシンホスファターゼの生理的役割 ③Naxチャンネルの生理的役割。テーマ①は留学時代の研究を発展させるもの、テーマ③は電位依存的に開口しないために謎のNaチャンネルとして残っていたNaxの役割の解明に挑戦するもので、今回の受賞の対象となったのはこれを発展させたものです。
体液(血液や脳脊髄液を含む細胞外液の総称)のNa+濃度が~145mMに維持される体液恒常性は生命維持にとって必須です。そのために、我々の脳は体液中のNa+濃度を常にモニターしており、その情報に基づいて水分あるいは塩分の摂取と排泄を制御しています。例えば、脱水状態では体液中のNa+濃度が上昇し、ヒトは喉の渇きを覚えて水を飲むとともに、脳下垂体から血中に抗利尿ホルモンが放出され、腎臓での水の再吸収を高め尿量を減少させます。体液恒常性の重要性は早くから認識されていましたが、脳内Naセンサーの実体は長い間不明でありました。
まずNax遺伝子のノックアウト(Nax-KO)マウスを作成し、その発現部位を解析したところ、Naxは脳内の感覚性脳室周囲器官(sCVOs)として知られる脳弓下器官(SFO)と終板脈管器官(OVLT)のグリア細胞(アストロサイトとタニサイト)に発現していました(J. Neurosci. 2000; Am. J. Physiol. 2006)。sCVOsは、脳内で神経細胞が存在しているにもかかわらず血液-脳関門が欠失している部位であり、第3脳室に面していることから、血液と脳脊髄液の両方の状態をモニターするのに適した場所でした。Naxを発現する細胞で細胞外液のNa+濃度を徐々に上げていくと、生理的濃度を越えた~150mMで開口し始めNa+流入が観察されました(Nat. Neurosci. 2002)。さらに、このNaxの活性化の[Na+]の閾値は、エンドセリン-3(ET-3)によって低濃度側にシフトすること、脱水条件下ではSFOにおいてET-3の発現が始まることを発見しました(Cell Metab. 2013)。脱水状態では、野生型のマウスは塩分摂取を抑制しますが、Nax-KOはこれを抑制せず、あたかもNaセンサーが欠失しているような行動を示します(J. Neurosci. 2000)。また、Naxに対する自己免疫疾患の患者は「口渇感を伴わない高Na血症」を発症していました(Neuron 2010)。
その後、SFOのNaxシグナルは主に塩分摂取の抑制(J. Neurosci. 2004)に、OVLTのNaxシグナルは水分摂取の誘導(Am. J. Physiol. 2016)に働いていることを突きとめました。Naxはグリア細胞に発現していますが、SFOでは、Naxの活性化の結果グリア細胞から分泌された乳酸が近傍の抑制性ニューロン(GABAニューロン)を活性化することによって、塩分摂取誘導ニューロンの活性を抑制し(Neuron 2007)、またOVLTでは、Naxの活性化によってグリア細胞からepoxyeicosatrienoic acids(EETs)が分泌され、近傍のTRPV4を発現する水分摂取誘導ニューロンを活性化していました(Am. J. Physiol. 2016)。
出血等で体液を失ったときには、水分と塩分の両方に対して渇望が生じますが、これは血液中のアンジオテンシンⅡ(AngⅡ)が上昇するためです。SFO内にAngⅡ受容体(AT1a)を発現する細胞群があり、これらが、OVLTあるいは腹側分界条床核(vBNST)に連絡していることを見出しました(Nat. Neurosci. 2017; 図1)。前者(水ニューロン)は水分欠乏時に、後者(塩ニューロン)は塩分欠乏時に活性化します。光遺伝学の手法を用いて、人為的に前者を活性化すると水分摂取が誘導され、後者を活性化すると塩分摂取が誘導されます。また、脳室内のコレシストキニン(CCK)は水分摂取を抑制しますが、塩分欠乏時にはSFO内でCCKの発現上昇が起こることを発見しました。このCCKはSFO内のCCK作動性ニューロンで作られており、CCK-B受容体陽性のGABAニューロンの活性化を介して水分摂取(水ニューロン)を抑制していること、さらに、CCKニューロンには、塩欠乏時に持続的に活性化するものと、飲水に伴って一過性に活性化するものの2種類があることが明らかになりました(Nat. Commun. 2020; 図2)。光遺伝学を用いて、それぞれのCCKニューロンを抑制すると水分摂取が誘導されることから、いずれも水分の過剰摂取を抑制する役割であることが分かります。最近、OVLTでは、Naxに加えて、SLC9A4(Na+/H+対向輸送体)も独立して体液のNa+濃度上昇を検知しており、両者が共力して水分摂取を制御していることが判明しました(Eur. J. Phys. 2020)。
塩分の過剰摂取によって体液のNa+濃度が上昇すると高血圧を発生しますが、Nax-KOマウスでは、体液のNa+濃度は野生型と同様に上昇するものの、高血圧を発症しません。そのシグナル伝達機構として、OVLTのNaxが[Na+]上昇を感知して活性化し、その結果Naxを発現するグリア細胞から乳酸とともにH+が分泌され、近傍の酸感受性チャンネル(ASIC1a)陽性のニューロンを活性化し、下流の交感神経制御中枢(室傍核(PVN)および頭側延髄腹外側野(RVLM))の活性化を通して、血圧上昇を誘発していることが分かりました(Neuron 2018)。
今後は、塩分摂取に伴う抑制メカニズム、並びに神経性高血圧の発生機序について研究できたらと思っております。
私は大学では、公害問題解決の一助になればと京大工学部の化学系を選んだ訳ですが、修士課程を終える頃には基礎研究の方がおもしろくなり、大学院の後期課程では医学研究科(京大医化学II:沼正作教授)に進学しました。大学院生から助手時代にかけて、エンケファリン前駆体の構造をcDNAクローニングによって明らかにするとともに、ニコチン性アセチルコリン受容体の全サブユニット(α、β、γ、δおよびε)のクローニングを行いました。続いて直ぐに助教授となったため、同教室でさらに数年過ごしてNaチャンネルの構造と機能の研究を行いました。その後、MPI発生生物学研究所(F. Bonhoeffer教授)へ留学しましたが、研究半ばで基礎生物学研究所の教授に選ばれ、急いで帰国することにしました。研究室を立ち上げるに当って3つのテーマを設定しました。①発生期における網膜の領域特異化と視神経の領域特異的投射の機構 ②受容体型プロテインチロシンホスファターゼの生理的役割 ③Naxチャンネルの生理的役割。テーマ①は留学時代の研究を発展させるもの、テーマ③は電位依存的に開口しないために謎のNaチャンネルとして残っていたNaxの役割の解明に挑戦するもので、今回の受賞の対象となったのはこれを発展させたものです。
体液(血液や脳脊髄液を含む細胞外液の総称)のNa+濃度が~145mMに維持される体液恒常性は生命維持にとって必須です。そのために、我々の脳は体液中のNa+濃度を常にモニターしており、その情報に基づいて水分あるいは塩分の摂取と排泄を制御しています。例えば、脱水状態では体液中のNa+濃度が上昇し、ヒトは喉の渇きを覚えて水を飲むとともに、脳下垂体から血中に抗利尿ホルモンが放出され、腎臓での水の再吸収を高め尿量を減少させます。体液恒常性の重要性は早くから認識されていましたが、脳内Naセンサーの実体は長い間不明でありました。
まずNax遺伝子のノックアウト(Nax-KO)マウスを作成し、その発現部位を解析したところ、Naxは脳内の感覚性脳室周囲器官(sCVOs)として知られる脳弓下器官(SFO)と終板脈管器官(OVLT)のグリア細胞(アストロサイトとタニサイト)に発現していました(J. Neurosci. 2000; Am. J. Physiol. 2006)。sCVOsは、脳内で神経細胞が存在しているにもかかわらず血液-脳関門が欠失している部位であり、第3脳室に面していることから、血液と脳脊髄液の両方の状態をモニターするのに適した場所でした。Naxを発現する細胞で細胞外液のNa+濃度を徐々に上げていくと、生理的濃度を越えた~150mMで開口し始めNa+流入が観察されました(Nat. Neurosci. 2002)。さらに、このNaxの活性化の[Na+]の閾値は、エンドセリン-3(ET-3)によって低濃度側にシフトすること、脱水条件下ではSFOにおいてET-3の発現が始まることを発見しました(Cell Metab. 2013)。脱水状態では、野生型のマウスは塩分摂取を抑制しますが、Nax-KOはこれを抑制せず、あたかもNaセンサーが欠失しているような行動を示します(J. Neurosci. 2000)。また、Naxに対する自己免疫疾患の患者は「口渇感を伴わない高Na血症」を発症していました(Neuron 2010)。
その後、SFOのNaxシグナルは主に塩分摂取の抑制(J. Neurosci. 2004)に、OVLTのNaxシグナルは水分摂取の誘導(Am. J. Physiol. 2016)に働いていることを突きとめました。Naxはグリア細胞に発現していますが、SFOでは、Naxの活性化の結果グリア細胞から分泌された乳酸が近傍の抑制性ニューロン(GABAニューロン)を活性化することによって、塩分摂取誘導ニューロンの活性を抑制し(Neuron 2007)、またOVLTでは、Naxの活性化によってグリア細胞からepoxyeicosatrienoic acids(EETs)が分泌され、近傍のTRPV4を発現する水分摂取誘導ニューロンを活性化していました(Am. J. Physiol. 2016)。
出血等で体液を失ったときには、水分と塩分の両方に対して渇望が生じますが、これは血液中のアンジオテンシンⅡ(AngⅡ)が上昇するためです。SFO内にAngⅡ受容体(AT1a)を発現する細胞群があり、これらが、OVLTあるいは腹側分界条床核(vBNST)に連絡していることを見出しました(Nat. Neurosci. 2017; 図1)。前者(水ニューロン)は水分欠乏時に、後者(塩ニューロン)は塩分欠乏時に活性化します。光遺伝学の手法を用いて、人為的に前者を活性化すると水分摂取が誘導され、後者を活性化すると塩分摂取が誘導されます。また、脳室内のコレシストキニン(CCK)は水分摂取を抑制しますが、塩分欠乏時にはSFO内でCCKの発現上昇が起こることを発見しました。このCCKはSFO内のCCK作動性ニューロンで作られており、CCK-B受容体陽性のGABAニューロンの活性化を介して水分摂取(水ニューロン)を抑制していること、さらに、CCKニューロンには、塩欠乏時に持続的に活性化するものと、飲水に伴って一過性に活性化するものの2種類があることが明らかになりました(Nat. Commun. 2020; 図2)。光遺伝学を用いて、それぞれのCCKニューロンを抑制すると水分摂取が誘導されることから、いずれも水分の過剰摂取を抑制する役割であることが分かります。最近、OVLTでは、Naxに加えて、SLC9A4(Na+/H+対向輸送体)も独立して体液のNa+濃度上昇を検知しており、両者が共力して水分摂取を制御していることが判明しました(Eur. J. Phys. 2020)。
塩分の過剰摂取によって体液のNa+濃度が上昇すると高血圧を発生しますが、Nax-KOマウスでは、体液のNa+濃度は野生型と同様に上昇するものの、高血圧を発症しません。そのシグナル伝達機構として、OVLTのNaxが[Na+]上昇を感知して活性化し、その結果Naxを発現するグリア細胞から乳酸とともにH+が分泌され、近傍の酸感受性チャンネル(ASIC1a)陽性のニューロンを活性化し、下流の交感神経制御中枢(室傍核(PVN)および頭側延髄腹外側野(RVLM))の活性化を通して、血圧上昇を誘発していることが分かりました(Neuron 2018)。
今後は、塩分摂取に伴う抑制メカニズム、並びに神経性高血圧の発生機序について研究できたらと思っております。
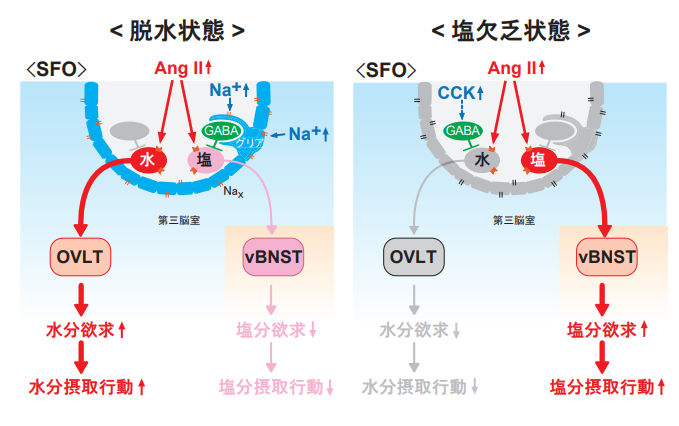
図1. 水分欲求および塩分欲求の制御機構
脱水状態(左)では、AngⅡとNa+の両方の濃度が高まる。AngⅡは水ニューロンと塩ニューロンの両方に作用するが、Na+濃度上昇によってNax陽性のグリア細胞が活性化し、続いてGABAニューロンが活性化するため、塩ニューロンの活動は抑えられ、専ら水ニューロンが活性化する。塩欠乏状態(右)では、AngⅡとCCKの両方の濃度が高まる。CCKが上記とは別のGABAニューロンを活性化することにより、水ニューロンの活動は抑えられ、塩ニューロンだけが活性化する。
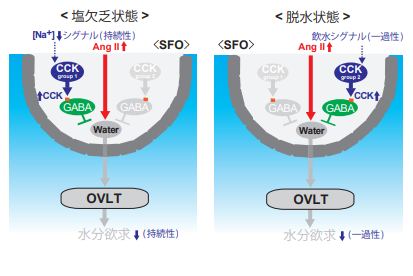
図2. 水分欲求が抑制される仕組みの詳細
塩欠乏状態(左)ではAngⅡ濃度は上昇しているが、体液中のNa⁺濃度は低下しており、同条件下で持続的に活性化状態にあるグループ1のCCKニューロンによって水分摂取は抑制される。また脱水状態(右)では水ニューロンは通常活性化状態にあるが、その活動は飲水に反応してそのつど一過性に抑制され、水分欲求は一時的に収まる。これはグループ2のCCKニューロンの働きによる。水ニューロンは、このように情況に応じてSFO内の異なるCCKニューロンによって抑制制御を受ける。

野田 昌晴(東京工業大学・科学技術創成研究院)
略歴
1977年3月 京都大学工学部工業化学科 卒業
1979年3月 京都大学工学研究科修士課程工業化学専攻 修了
1983年10月 京都大学医学研究科博士課程生理系専攻 修了
1983年4月 日本学術振興会 奨励研究員
1984年4月 京都大学医学部 助手
1985年4月 京都大学医学部 助教授
1989年4月-1991年8月 マックスプランク発生生物学研究所 客員研究員
1991年9月 基礎生物学研究所 教授、総合研究大学院大学 教授
2019年4月 東京工業大学 科学技術創成研究院 特任教授
1977年3月 京都大学工学部工業化学科 卒業
1979年3月 京都大学工学研究科修士課程工業化学専攻 修了
1983年10月 京都大学医学研究科博士課程生理系専攻 修了
1983年4月 日本学術振興会 奨励研究員
1984年4月 京都大学医学部 助手
1985年4月 京都大学医学部 助教授
1989年4月-1991年8月 マックスプランク発生生物学研究所 客員研究員
1991年9月 基礎生物学研究所 教授、総合研究大学院大学 教授
2019年4月 東京工業大学 科学技術創成研究院 特任教授





