平成28年度時実利彦記念賞受賞者 影山龍一郎先生
「神経幹細胞の増殖と分化制御機構の解明とその操作」
神経幹細胞の増殖と分化制御機構の解明とその操作京都大学ウイルス研究所教授;物質—細胞統合システム拠点副拠点長 影山龍一郎
この度は思いもかけず、平成28年度時実利彦記念賞を受賞することになり、たいへん光栄に存じます。選考委員ならびに関係者の皆様に深く感謝申し上げます。
私は、1989年末に米国留学から帰国後、一貫して哺乳動物の神経発生の分子機構について研究を行ってきました。当時は、筋肉分化決定因子MyoDや神経分化制御因子Mash1が同定されていました。いずれの因子もbasic helix-loop-helix (bHLH)型転写因子ファミリーに属していることから、神経発生を制御する新たなbHLH因子の同定を試みました。1991年にbHLH因子Hes1を同定し、MyoDやMash1に拮抗する分化抑制因子であることを報告しました(Genes Dev 1992; EMBO J 1994)。さらに、Hes1欠損マウスでは、Mash1の発現が増えてニューロン分化が亢進するため、神経管形成不全になることを示し、Hes1が神経幹細胞の維持に重要な役割を担うことを明らかにしました(Genes Dev 1995; Neuron 1996)。Hes1には同じファミリーに属する因子があり、さらにこれらの機能解析も進めました(EMBO J 2001; Development 2004; 2006)。その結果、Hes1とHes5はNotchシグナルのエフェクターとして必須な役割を担うことも明らかになりました(EMBO J 1999)。当時は、他のHes因子の研究もおそらく2000年過ぎ頃までにはすべて終わり、21世紀には新たな分野の研究に従事するだろうと漠然と考えていました。しかし、予想もしない展開になり、Hes1を同定してから25年経った今でもHesの研究を続けることになりました。
まず、線維芽細胞において、Hes1の発現がネガティブフィードバックによって2〜3時間周期で振動することがわかりました(Science 2002; PNAS 2006)。さらに、Hes1プロモーター下に不安定化ルシフェラーゼをつないだHes1レポーターをもつトランスジェニックマウスを作製し、神経幹細胞のライブイメージングを行ったところ、2〜3時間周期でHes1の発現が振動していました(Neuron 2008)。また、Hes1の発現振動によって周期的に抑制されるために、標的遺伝子であるプロニューラル遺伝子Neurog2やMash1/Ascl1、NotchリガンドであるDeltalike1 (Dll1)の発現も2〜3時間周期で振動しました(Neuron 2008; Nat Neurosci 2008; Science 2013)。神経幹細胞では、オリゴデンドロサイトの分化決定に働くbHLH因子Olig2の発現も振動しました。一方、ニューロン、オリゴデンドロサイト、アストロサイトの分化決定時には、それぞれMash1、Olig2、Hes1の発現は持続していました。我々や他のグループの研究から、Mash1、Olig2、Hes1は、細胞分化の運命決定だけでなく、神経幹細胞の増殖・維持にも重要なことが示されていました。すなわち、これら3種類の運命決定因子は、運命決定だけでなく、神経幹細胞の増殖・維持という相反する機能を持つことが示唆されていました。同一因子によってこの逆の活性を発揮する分子機構は不明でしたが、我々のライブイメージング解析から、神経幹細胞では3種類の因子の発現が振動するのに対し、分化決定時にはどれか一つの因子が持続発現してその他は抑制されることが分かりました。したがって、発現動態の違いによって神経幹細胞の増殖・維持や細胞分化決定に働くことが示唆されました。
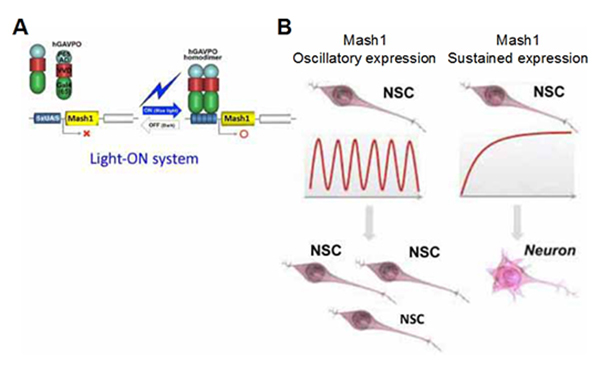
この発現動態と機能との因果関係を明らかにするために、Mash1について解析を進めました。そのために、青色光照射によって遺伝子発現を誘導する新たな光遺伝学的技術を開発し(図1A)、Mash1の発現を振動させたところ、神経幹細胞の増殖が活性化されました(図1B左)。一方、Mash1の発現を持続させると神経幹細胞は増殖を止めてニューロンに分化しました(図1B右)(Science 2013)。これらの結果から、多分化能とは多種類の運命決定因子の発現が振動している状態のことで、運命決定は選ばれた1種類の運命決定因子が持続発現する状態であることが明らかになりました(Science 2013; Neuron 2014)。また、この新たな光操作技術によって、青色光の照射パターンを変えるだけで神経幹細胞の増殖やニューロン分化を自由に制御することが可能になりました。さらに下流因子について調べたところ、NotchリガンドDll1に関しても発現振動が神経幹細胞の増殖・維持に重要であることが明らかになりました(Genes Dev 2016)
このように、各種因子の機能発揮における発現動態の重要性が明らかになり、また光操作で神経幹細胞を制御できるようになりました。これら一連の成果を評価していただき、受賞に至りました。これまで一緒に研究を進めてくれた研究室のメンバーや共同研究者の皆様に深く感謝いたします。しかし、本研究はまだまだ道半ばです。なぜ同一因子が発現動態(振動か定常か)を変えるだけで逆の機能を発揮するのか、胎児と成体で神経幹細胞の性質が異なるのはどのような分子機構か、といった多くの疑問が残されたままです。このような疑問に答えるべく、ますます研究に精進したいと考えています。今後とも、皆様のご指導ご鞭撻の程、よろしくお願い申し上げます。
図説
図1:(A) 青色光照射によってhGAVPOは活性化されMash1の発現が誘導される(右)。光が消えると、Mash1の発現は無くなる(左)。(B) Mash1の発現振動で神経幹細胞(NSC)が効率良く増殖した(左)。一方、Mash1の持続発現では効率良くニューロンに分化した(右)。
略歴
昭和57年3月 京都大学医学部 卒業
昭和57年4月 京都大学大学院医学研究科博士課程
昭和61年3月 同上修了。京大医博取得。
昭和61年6月 米国国立癌研究所 客員研究員
平成元年12月 京都大学医学部附属免疫研究施設 助手
平成3年12月 同上 助教授
平成7年 4月 京都大学大学院医学研究科生体情報科学講座 助教授
平成9年12月〜現在 京都大学ウイルス研究所 教授
平成18年4月〜平成22年3月 京都大学ウイルス研究所 所長
平成25年2月〜現在 京都大学物質—細胞統合システム拠点 副拠点長 併任






