2022年度時実利彦記念賞受賞者 長谷川 成人 先生 受賞の言葉
神経変性疾患における異常タンパク質の病変形成機構
公益財団法人東京都医学総合研究所 長谷川成人
この度は2022年度時実利彦記念賞を頂くこととなり、大変光栄に感じますとともに身の引き締まる思いです。選考委員ならびに日本神経科学学会の皆様に厚く御礼を申し上げます。
私は富山大学理学部でホヤをテーマに卒業研究し、筑波大学で糸状菌のレクチンに対するモノクローナル抗体の作製で修士を取得しました。その後、化学系企業に就職しましたが、研究を諦められず、東京都老人総合研究所の井原康夫先生を紹介して頂き、認知症の研究をすることになりました。井原先生に最初に渡された総説に「アルツハイマー病は蓄積病である。アプローチは簡単で蓄積しているものを分析すればいい」とありました。読んだ当初はその面白さに気付きませんでしたが、研究を始めると抗体作製に加え、患者脳の解析を中心にした疾患研究に夢中になりました。抗体を用いた解析の利点を学ぶと同時に限界も感じ、理研に一年通いタンパク化学の勉強をさせて頂きました。そこでアルツハイマー患者脳からタウを精製、脱リン酸化前後で質量分析を行い、リン酸化部位を同定しました。この仕事で学位を取得させて頂きましたが、時が経っても事実として残る患者脳の解析の重要性を認識しました。その後、タウをリン酸化して線維化する実験に取り組みましたがことごとく失敗に終わりました。
1995年、森啓先生の勧めで当時競争相手でもあった英国MRC分子生物学研究所のMichel Goedert先生の研究室に留学しました。驚いたのは、研究所内にノーベル賞学者が何人もいて皆と同じように普通に研究していたことです。中でもAaron Krug先生とはランチの時などにしばしば会話をする機会がありました。滞在中、Goedert研では認知症研究史に残る大きな発見が相次ぎました。ヘパリンの添加によりリン酸化に関係なくタウが線維化することが偶然に見つかりました。また、家族性パーキンソン病の原因遺伝子にコードされるαシヌクレインがレビー小体の構成成分として同定されました。さらに家族性認知症の原因となるタウ遺伝子の変異が発見されました。そんな中、東大薬学部の教授になられた岩坪威先生から声をかけて頂き帰国しました。岩坪研ではレビー小体型認知症患者に蓄積したαシヌクレインの解析をさせて頂き、幸運なことにαシヌクレインの異常リン酸化やユビキチン化を同定することができました。2001年、東京都精神医学総合研究所に移ると、池田研二先生に「成分不明の構造物がある。これがわかると大きいよ」と教えられ、新井哲明先生と解析に取り組みました。報告自体は米国の競争相手に先を越されましたが、前頭側頭葉変性症、筋萎縮性側索硬化症に特徴的な病理構造物の構成成分としてリン酸化TDP-43を同定しました。これで主要な神経変性疾患の主役(タウ、αシヌクレン、TDP-43)が出揃うことになるのですが、大きな疑問が残りました。本来は脳で生理的な役割を果たしているタンパク質が「なぜ異常化して蓄積するのか?」、またそれが病気の進行に伴って「なぜ脳内に広がるのか?」ということです。「病変の広がり」=「病気の進行」と考えられ、そこが最も重要と考えました。
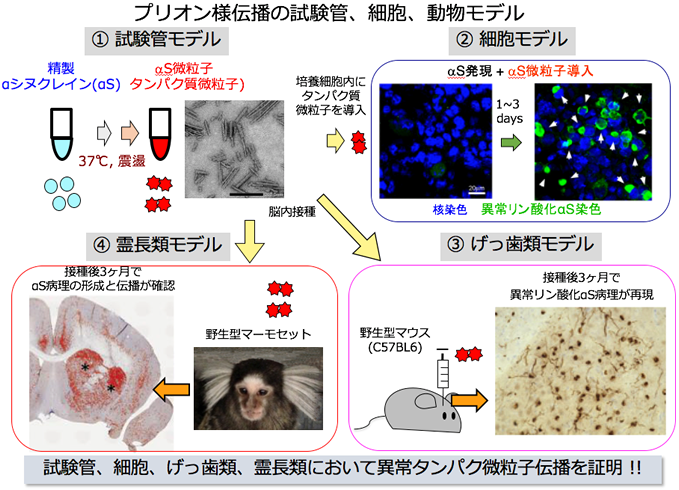
患者脳のタンパク質病変を再現するため、変異タンパク質の過剰発現、ストレス負荷、薬剤処理等によるリン酸化亢進やタンパク分解抑制など様々な検討を試みましたが、培養細胞やマウスにおける病変は患者脳とは大きく異なっていました。根本的な発想の転換が必要と感じていた時、「凝集核(シード)形成が律速であり、その後の線維化は早く進む」という論文を読み、これをヒントに「プリオン様伝播」の考えを着想しました。異常型となったタンパク質がシードとして働き、感染因子プリオンのように正常タンパク質を異常型に変換して増殖し、脳内に広がるという仮説です。検証のため、合成線維や患者脳由来の線維をαシヌクレイン、タウ、TDP-43を発現する細胞に導入を試みた結果、添加したタンパク質線維と同種のタンパク質が細胞内で凝集することを見出し、「プリオン様伝播」の細胞モデルが完成しました。この細胞モデルの構築には野中隆研究員、渡辺小百合さんが大きな貢献をしました。さらにin vivoでの検証を行うため、合成αシヌクレイン線維やタウ線維を野生型マウスの脳に接種する実験を行い、異常化したタンパク質そのものが病変形成を引き起こし、さらには神経回路に沿って伝播することを実証しました。同時に、患者脳由来の線維がプリオン様伝播活性を有することも証明しました。
私は富山大学理学部でホヤをテーマに卒業研究し、筑波大学で糸状菌のレクチンに対するモノクローナル抗体の作製で修士を取得しました。その後、化学系企業に就職しましたが、研究を諦められず、東京都老人総合研究所の井原康夫先生を紹介して頂き、認知症の研究をすることになりました。井原先生に最初に渡された総説に「アルツハイマー病は蓄積病である。アプローチは簡単で蓄積しているものを分析すればいい」とありました。読んだ当初はその面白さに気付きませんでしたが、研究を始めると抗体作製に加え、患者脳の解析を中心にした疾患研究に夢中になりました。抗体を用いた解析の利点を学ぶと同時に限界も感じ、理研に一年通いタンパク化学の勉強をさせて頂きました。そこでアルツハイマー患者脳からタウを精製、脱リン酸化前後で質量分析を行い、リン酸化部位を同定しました。この仕事で学位を取得させて頂きましたが、時が経っても事実として残る患者脳の解析の重要性を認識しました。その後、タウをリン酸化して線維化する実験に取り組みましたがことごとく失敗に終わりました。
1995年、森啓先生の勧めで当時競争相手でもあった英国MRC分子生物学研究所のMichel Goedert先生の研究室に留学しました。驚いたのは、研究所内にノーベル賞学者が何人もいて皆と同じように普通に研究していたことです。中でもAaron Krug先生とはランチの時などにしばしば会話をする機会がありました。滞在中、Goedert研では認知症研究史に残る大きな発見が相次ぎました。ヘパリンの添加によりリン酸化に関係なくタウが線維化することが偶然に見つかりました。また、家族性パーキンソン病の原因遺伝子にコードされるαシヌクレインがレビー小体の構成成分として同定されました。さらに家族性認知症の原因となるタウ遺伝子の変異が発見されました。そんな中、東大薬学部の教授になられた岩坪威先生から声をかけて頂き帰国しました。岩坪研ではレビー小体型認知症患者に蓄積したαシヌクレインの解析をさせて頂き、幸運なことにαシヌクレインの異常リン酸化やユビキチン化を同定することができました。2001年、東京都精神医学総合研究所に移ると、池田研二先生に「成分不明の構造物がある。これがわかると大きいよ」と教えられ、新井哲明先生と解析に取り組みました。報告自体は米国の競争相手に先を越されましたが、前頭側頭葉変性症、筋萎縮性側索硬化症に特徴的な病理構造物の構成成分としてリン酸化TDP-43を同定しました。これで主要な神経変性疾患の主役(タウ、αシヌクレン、TDP-43)が出揃うことになるのですが、大きな疑問が残りました。本来は脳で生理的な役割を果たしているタンパク質が「なぜ異常化して蓄積するのか?」、またそれが病気の進行に伴って「なぜ脳内に広がるのか?」ということです。「病変の広がり」=「病気の進行」と考えられ、そこが最も重要と考えました。
患者脳のタンパク質病変を再現するため、変異タンパク質の過剰発現、ストレス負荷、薬剤処理等によるリン酸化亢進やタンパク分解抑制など様々な検討を試みましたが、培養細胞やマウスにおける病変は患者脳とは大きく異なっていました。根本的な発想の転換が必要と感じていた時、「凝集核(シード)形成が律速であり、その後の線維化は早く進む」という論文を読み、これをヒントに「プリオン様伝播」の考えを着想しました。異常型となったタンパク質がシードとして働き、感染因子プリオンのように正常タンパク質を異常型に変換して増殖し、脳内に広がるという仮説です。検証のため、合成線維や患者脳由来の線維をαシヌクレイン、タウ、TDP-43を発現する細胞に導入を試みた結果、添加したタンパク質線維と同種のタンパク質が細胞内で凝集することを見出し、「プリオン様伝播」の細胞モデルが完成しました。この細胞モデルの構築には野中隆研究員、渡辺小百合さんが大きな貢献をしました。さらにin vivoでの検証を行うため、合成αシヌクレイン線維やタウ線維を野生型マウスの脳に接種する実験を行い、異常化したタンパク質そのものが病変形成を引き起こし、さらには神経回路に沿って伝播することを実証しました。同時に、患者脳由来の線維がプリオン様伝播活性を有することも証明しました。
近年は患者脳に蓄積する線維の構造的理解がメカニズム解明に重要と考え、Goedert先生らとの共同研究を開始しました。クライオ電子顕微鏡を用いた構造解析において成功の鍵を握るのは、99%試料の良し悪しであるといわれていますので、電顕で観察しながら剖検脳の選別や抽出条件を検討し線維を調製しました。その試料をMRCで解析すると、大脳皮質基底核変性症のタウ線維、多系統萎縮症のαシヌクレイン線維、進行性核上性麻痺、嗜銀性顆粒認知症、球状グリア性タウオパチーのタウ線維の三次元構造が次々に明らかとなりました。その折り畳みは疾患特徴的であり、折り畳まれたタンパク質が規則正しく積み重なるようにして線維を形成していることが明らかとなりました。これらの結果は、線維化したタンパク質が鋳型となって正常タンパク質を異常化することを強く示唆するものです。今後はこれらの異常型タンパク質の構造に基づく疾患修飾薬や治療法の開発を目指したいと思います。
最後に、これまでの研究を一緒に進め、支えてくれた研究室のメンバー、技術員、学生、多くの共同研究の先生に感謝を申し上げます。特に大所高所からご指導下さり、研究の面白さ、素晴らしさを教えて下さった井原康夫先生、故瀧尾拡士先生、Michel Goedert先生、岩坪威先生、そして故葛原茂樹先生にお礼を申し上げたいと思います。
最後に、これまでの研究を一緒に進め、支えてくれた研究室のメンバー、技術員、学生、多くの共同研究の先生に感謝を申し上げます。特に大所高所からご指導下さり、研究の面白さ、素晴らしさを教えて下さった井原康夫先生、故瀧尾拡士先生、Michel Goedert先生、岩坪威先生、そして故葛原茂樹先生にお礼を申し上げたいと思います。

長谷川成人
公益財団法人 東京都医学総合研究所 脳・神経科学研究分野長
認知症プロジェクトリーダー
認知症プロジェクトリーダー
略歴
1986年 筑波大学 大学院 修士課程 環境科学研究科 修了
1992年 博士(医学)(東京大学医学部 論文博士)
1993年 東京大学 医学部 脳研究施設 脳病理学部門 助手
1995年 英国MRC Laboratory of Molecular Biology Visiting Scientist
1999年 東京大学 大学院 薬学系研究科 臨床薬学教室 講師
2001年 東京都精神医学総合研究所 分子神経生物学研究部門長
2016年 東京都医学総合研究所 脳・高次脳機能研究分野長
2020年 東京都医学総合研究所 脳・神経科学研究分野長
1992年 博士(医学)(東京大学医学部 論文博士)
1993年 東京大学 医学部 脳研究施設 脳病理学部門 助手
1995年 英国MRC Laboratory of Molecular Biology Visiting Scientist
1999年 東京大学 大学院 薬学系研究科 臨床薬学教室 講師
2001年 東京都精神医学総合研究所 分子神経生物学研究部門長
2016年 東京都医学総合研究所 脳・高次脳機能研究分野長
2020年 東京都医学総合研究所 脳・神経科学研究分野長
Masato Hasegawa
Head, Department of Brain and Neurosciences,
Tokyo Metropolitan Institute of Medical Science
Tokyo Metropolitan Institute of Medical Science
CV
1986 M.Sc. Faculty of Environmental Science, Tsukuba University (Biochemistry)
1992 Ph.D. Faculty of Medicine, The University of Tokyo (Neurobiology)
1993 Assistant Professor, Faculty of Medicine, The University of Tokyo
1995 Visiting Scientist, MRC Laboratory of Molecular Biology, Cambridge, UK
1999 Associate Professor, The University of Tokyo
2001 Head of Neurobiology Group, Tokyo Institute of Psychiatry
2016 Head of Department, Tokyo Metropolitan Institute of Medical Science.
1992 Ph.D. Faculty of Medicine, The University of Tokyo (Neurobiology)
1993 Assistant Professor, Faculty of Medicine, The University of Tokyo
1995 Visiting Scientist, MRC Laboratory of Molecular Biology, Cambridge, UK
1999 Associate Professor, The University of Tokyo
2001 Head of Neurobiology Group, Tokyo Institute of Psychiatry
2016 Head of Department, Tokyo Metropolitan Institute of Medical Science.





